HIGH COLLAGEN
Vegan Boost®
Für schöne Haut, Haare & Nägel,
festes Bindegewebe sowie
gesunde Gelenke & Knochen
HIGH COLLAGEN Vegan Boost®
Das innovative Nahrungsergänzungsmittel zur Kollagenproduktion
Die Kollagenfasern sind die zentralen Bausteine von allen Bindegeweben. Sie unterstützen sowie stabilisieren Fasern und Gewebe. Kollagen befindet sich fast überall in unserem Körper: in der Haut, den Knochen, Muskeln und Sehnen, im Knorpel und in den gesamten Bindegeweben.
Unser Körper produziert das Kollagen selbst, jedoch verlangsamt sich die Kollagenbildung nach dem 20. Lebensjahr.
Als Folge davon kommt es zu brüchigen Nägeln und Haaren, trockener Haut und Falten, Muskelabbau, unflexiblen Gelenken und Bewegungseinschränkungen.
Um dem entgegen zu wirken macht es Sinn, den Körper mit hochwertigem Kollagen zu unterstützen. Mit der Einnahme von HIGH COLLAGEN Vegan Boost® wird die körpereigene Kollagenproduktion stimuliert & gefördert. Der Körper kann wieder vermehrt Kollagen produzieren, um die essenziellen Funktionen zu erfüllen.
Kollagen ist also mehr als ein Kosmetikprodukt, es wirkt von innen, holistisch auf unseren ganzen Körper!
Tu dir etwas Gutes und helfe deinem Körper, wieder mehr Kollagen zu produzieren!
Wertvolle Inhaltsstoffe:
HIGH COLLAGEN Vegan Boost® ist eine Mischung aus Aminosäuren, die zusammen mit Induktoren (Vitamin C, Indischem Wassernabel & Ginseng) den menschlichen Körper dazu anregen, natives Kollagen zu bilden und zu verwenden.
Hyaluronsäure ist ein zusätzlicher, natürlicher Feuchtigkeitsspender für die Haut, stärkt die Hautbarriere und verringert Fältchen.
VeCollal®
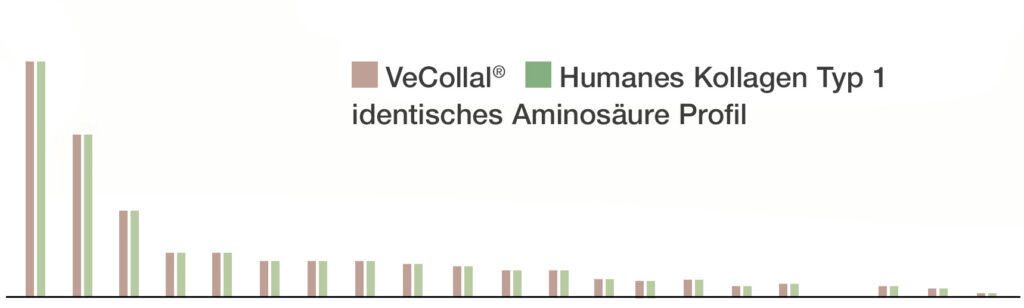
imitiert das Profil des menschlichen Kollagen Typ-1 und versorgt den Körper mit allen Aminosäuren
Kollagen
hilft die Faltentiefe zu reduzieren, die Hautelastizität zu verbessern & für ein straffes Hautbild und Bindegewebe zu sorgen

Hyaluronsäure
ist ein natürlicher Feuchtigkeitsspender für die Haut, stärkt die Hautbarriere und verringert Fältchen
Vitamin C
Vitamin C trägt zur normalen Kollagenproduktion & Hautfunktion bei
Veganes Kollagen – Gibt es das?
Nur Menschen und Tiere können Kollagen bilden. Der Körper kann aber das nötige Kollagen problemlos selbst bilden, wenn er ausreichend mit guten Aminosäuren versorgt wird.
HIGH COLLAGEN Vegan Boost®, enthält alle Aminosäuren sowie spezielle Induktoren und stimuliert die körpereignen Kollagenproduktion. Der Wirkmechanismus dieser innovativen Formulierung wurde durch diverse klinische Studien bestätigt.

Was ist VeCollal®?

Wissenschaftliche Innovation
VeCollal® ist die weltweit erste pflanzliche (vegane) Kollagenalternative, die auf wissenschaftlichen Erkenntnissen basiert und von nachhaltiger Innovation inspiriert ist

Analyse des menschlichen Kollagens
VeCollal® wurde in Zusammenarbeit mit dem Hautgewebeingenieur Josué Jiménez Vázquez, PhD, und dem weltweit führenden Handelsmarkenhersteller Aminolabs entwickelt und ahmt das menschliche Kollagen Typ-1 Profil mit pflanzlichen Inhaltsstoffen nach

Vegan, pflanzlich
VeCollal® wurde unter Berücksichtigung der Umwelt entwickelt. Nachhaltige Produktion und pflanzliche Inhaltsstoffe bieten alle Vorteile traditioneller Kollagenpräparate auf tierischer Basis
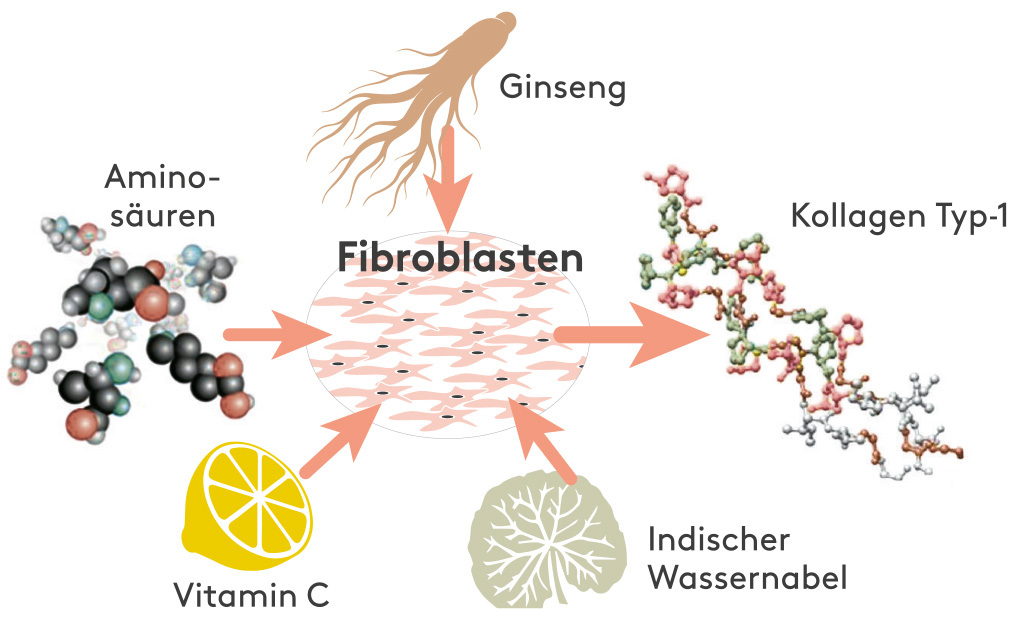
* Die Prinzipien, die die Grundlage von VeCollal® bilden,
werden durch über 50 Studien gestüzt
VeCollal® liefert dem Körper die notwendigen Bausteine für die Produktion von Kollagen Typ-1, indem es das exakte Aminosäurenprofil von menschlichem Kollagen Typ-1 nachahmt. Es kann als Biomimetikum des menschlichen Kollagen Typ- 1 betrachtet werden.
VeCollal® zielt darauf ab, den natürlichen Syntheseprozess für Kollagen Typ-1 unter Verwendung von veganen Analoga nachzuahmen.
Ausgewählte Induktoren signalisieren dem Körper, die verfügbaren Aminosäuren, für die Produktion von Kollagen zu verwenden.*

Ein einzigartiges Biomimetikum des menschlichen Kollagens Typ-1
Das in High Collagen Vegan Boost® enthaltene VeCollal®, ein einzigartiges Biomimetikum des menschlichen Kollagens Typ-1, hat genau das gleiche Aminosäureprofil wie das Kollagen, das in menschlichem Kollagen vorkommt.
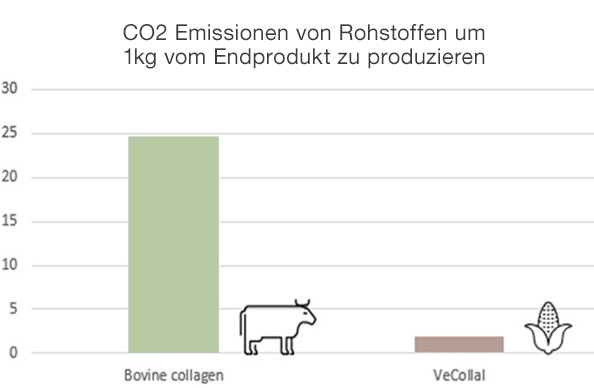
Niedriger CO2-Fußabdruck und Clean Formula
Im Vergleich zu Rinderkollagen verursacht die Herstellung von VeCollal® einen achtmal geringeren CO2-Ausstoß. VeCollal® ist eine umweltfreundliche, nachhaltige und saubere Formulierung für den natürlichen Aufbau von Kollagen im Körper.

Klinische Studien
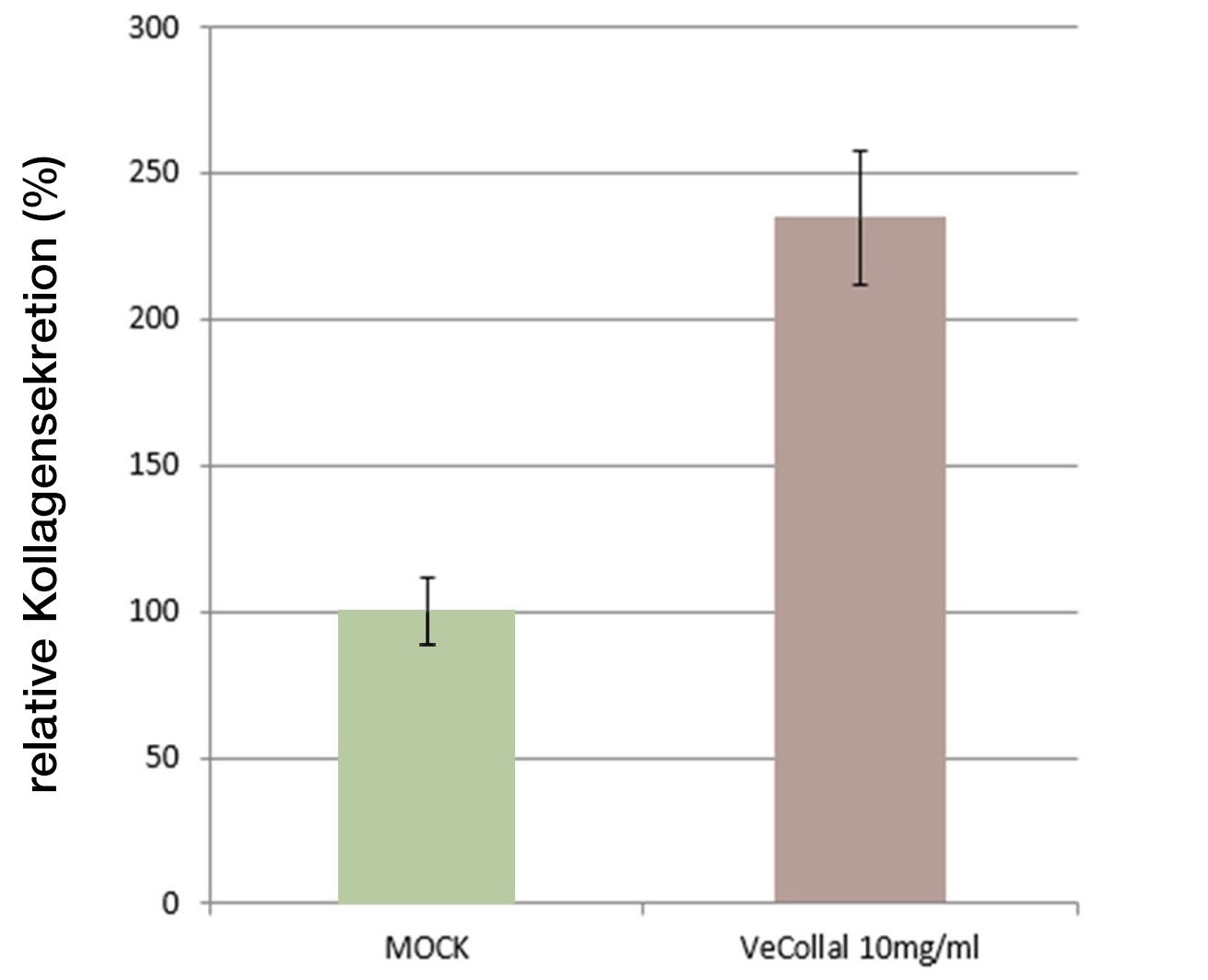
Durch In-vitro-Forschung wurde nachgewiesen, dass VeCollal® menschliche Fibroblastenzellen dazu anregen kann, um 134,97% mehr Kollagen abzusondern.
Es wurden menschliche Hautfibroblasten verwendet (die wichtigsten Zelltypen, die an der Kollagensynthese beteiligt sind).
Verschiedene Konzentrationen von VeCollal® wurden im Kulturmedium getestet und mit dem Kollagen verglichen, das mit Zellen ohne Behandlung exprimiert wurde (MOCK).
Die Ergebnisse zeigten, dass die VeCollal®-Formulierung bei einer Konzentration von 10 mg/ml die Synthese von neuem Kollagen in den Zellen induziert.

Klinische Wirksamkeitsbewertung
Vorwort: Ziel der Studie ist die Bewertung der Wirksamkeit von VeCollal® auf die Schönheit der Haut.
→ Beispiel: VeCollal® Sachet (3.885 g/sachet)
- Placebo Sachet
- Dosierung: 1 Sachet/Tag
→ Probanden: Total 15 Erwachsene (VeCollal®: Placebo = 10 : 5), Alter 25-65 Jahre
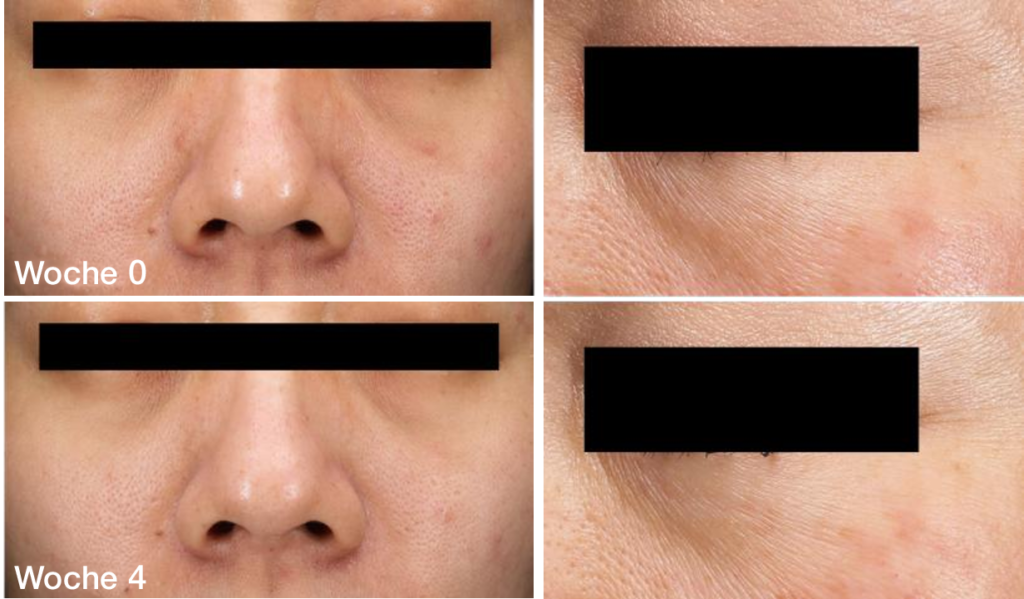
→ Methode: Es wurde eine placebokontrollierte Studie durchgeführt. Die Probanden wurden angewiesen, 4 Wochen lang täglich 1 Sachet VeCollal® oder Placebo zu sich zu nehmen. Jeder Proband musste sich in Woche 0, Woche 2 und Woche 4 einer Messung des Hautzustands und einer Blutentnahme unterziehen.
→ Testgegenstand:
- Falten
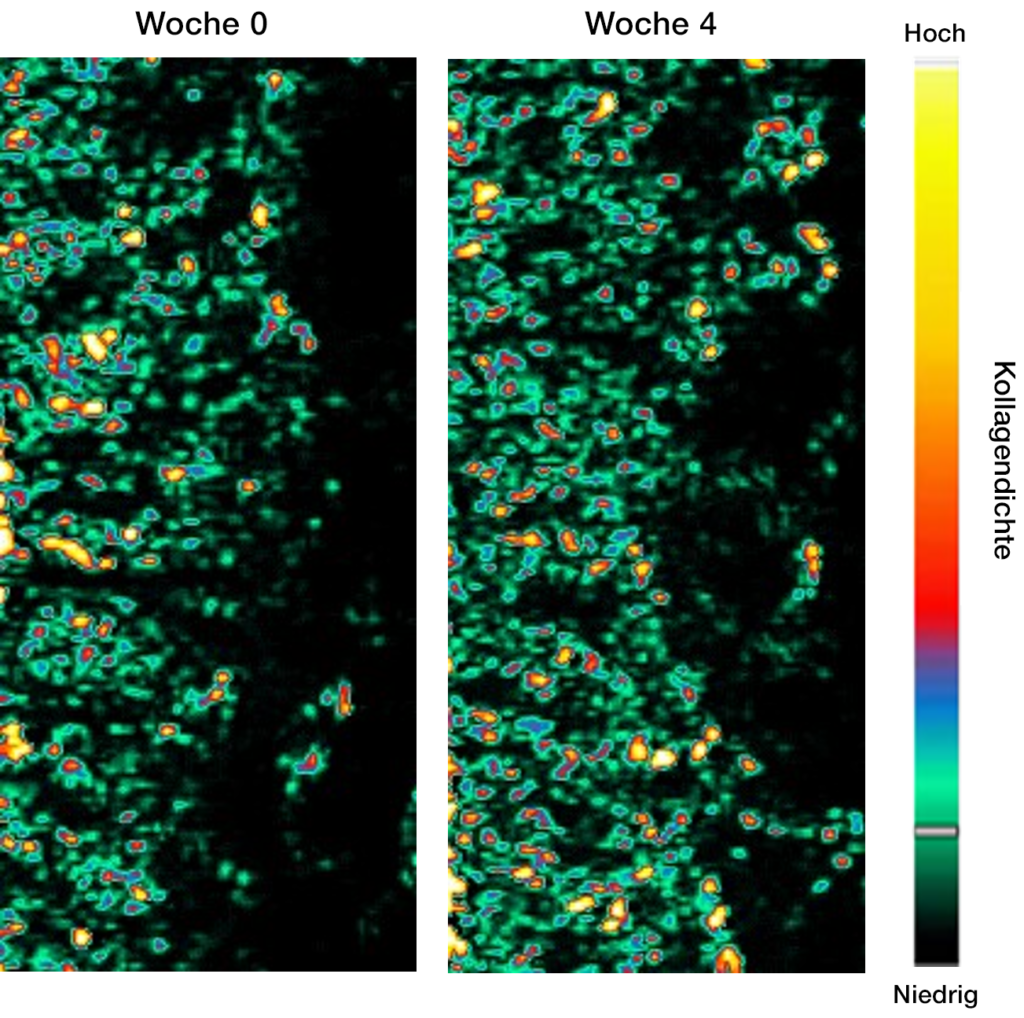
- Kollagendichte der Haut
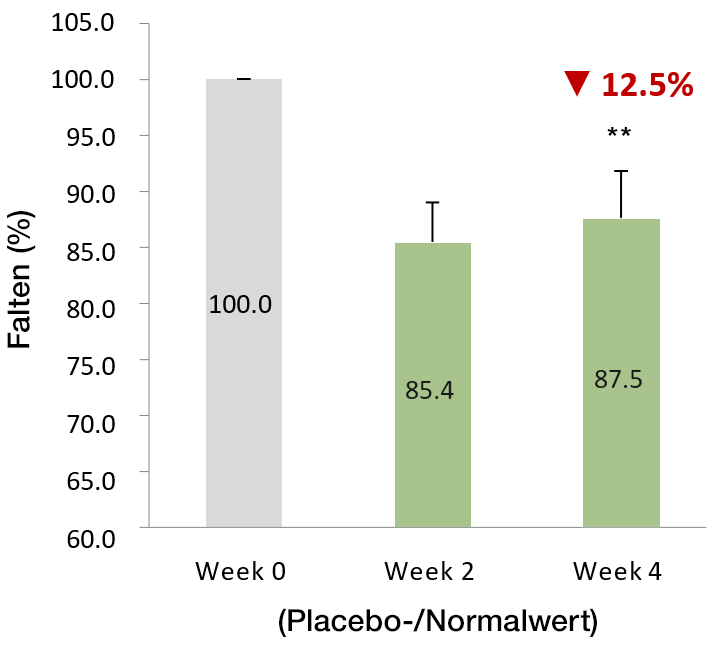
VeCollal® hat das Potenzial Falten zu reduzieren
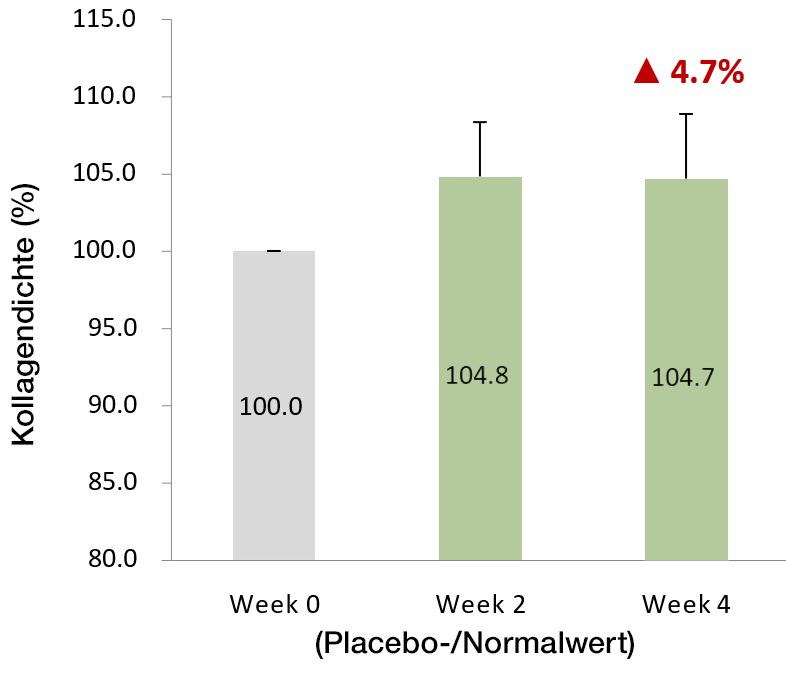
und die Kollagensynthese anzukurbeln
Nach 4-wöchiger Einnahme von VeCollal® war der durchschnittliche Faltenwert um 12,5% niedriger als in der ersten Woche. Das Verhältnis der Probanden, die eine effektive Verbesserung aufwiesen, zur Gesamtteilnehmerzahl betrug 80,0%.
Die gemessene Kollagendichte der Haut hat durschschnittlich um 4.7% zugenommen.
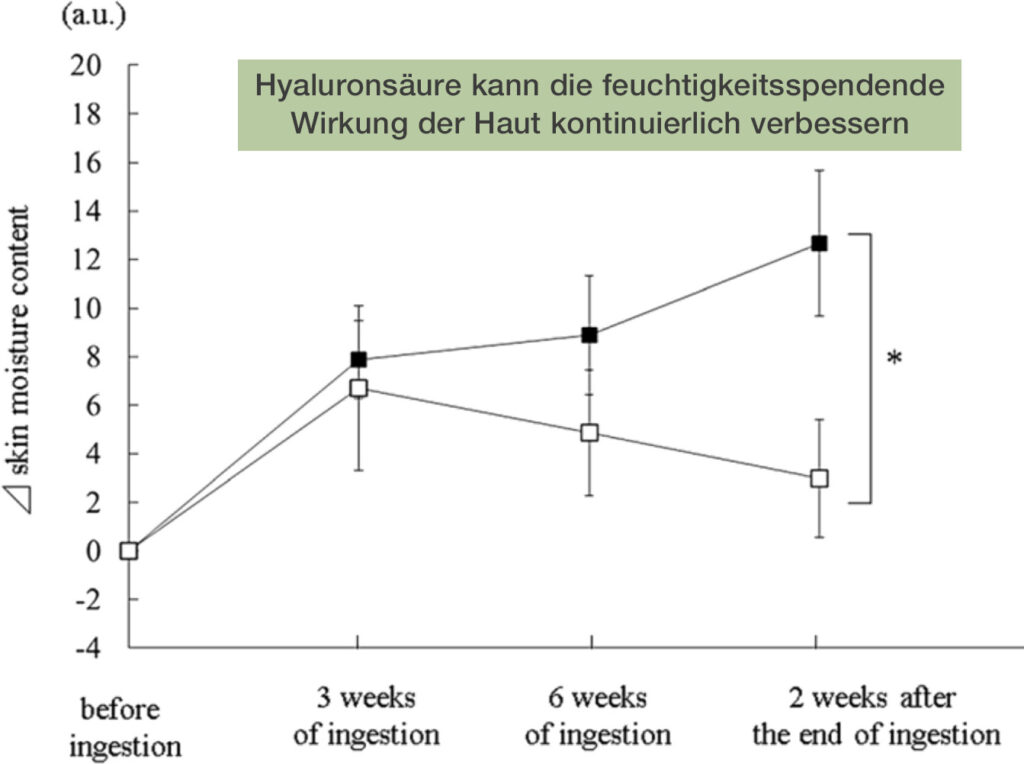
Hyalurosäure
Der Feuchtigkeitsgehalt ist essentiell für ein jugendliches Aussehen. Mit zunehmendem Alter verliert das Wasser allmählich an Festigkeit und Zartheit. Hyaluronan ist ein Glykosaminoglykan, ein natürlicher Feuchtigkeitsfaktor für die Haut und kommt häufig im Bindegewebe des menschlichen Körpers vor.
Das Wasserrückhaltevermögen von Hyaluronsäure ist stärker als das anderer natürlicher oder synthetischer Polymere. Tatsächlich kann ein Gramm Hyaluronsäure sechs Liter Wasser aufnehmen (sechstausendfache Absorption).
International Journal of Toxicology, Juli/August 2009
→ Verbessert die Hautfeuchtigkeit
→ Hautbarriere stärken
→ Verbessert feine Linien

SUPPORTING STUDIES IN THE FORMULATION OF VECOLLAL®
- Avila Rodríguez, M.I., L.G. Rodriguez Barroso, and M.L. Sánchez, Collagen: A review on its sources and potential cosmetic applications. Journal of Cosmetic Dermatology, 2018. 17(1): p. 20-26.
- Czajka, A., et al., Daily oral supplementation with collagen peptides combined with vitamins and other bioactive compounds improves skin elasticity and has a beneficial effect on joint and general wellbeing. Nutrition Research, 2018. 57: p. 97-108.
- Rossert, J., C. Terraz, and S. Dupont, Regulation of type I collagen genes expression.
Nephrology Dialysis Transplantation, 2000. 15(suppl_6): p. 66-68.
- Davison-Kotler, E., W.S. Marshall, and E. García-Gareta, Sources of collagen for biomaterials in skin wound healing. Bioengineering, 2019. 6(3): p. 56.
- Canty, E.G. and K.E. Kadler, Procollagen trafficking, processing and fibrillogenesis.
Journal of cell science, 2005. 118(7): p. 1341-1353.
- Tang, M., et al., Effect of Hydroxylysine-O-glycosylation on the structure of type I collagen molecule: A computational study. Glycobiology, 2020.
- Silvipriya, K., et al., Collagen: Animal sources and biomedical application. Journal of Applied Pharmaceutical Science, 2015. 5(3): p. 123-127.
- Lestari, W., et al., Plant-Based Substitutes for Gelatin, in Contemporary Management and Science Issues in the Halal Industry. 2019, Springer. p. 319-322.
- Oesser, S., et al., Oral administration of 14C labeled gelatin hydrolysate leads to an accumulation of radioactivity in cartilage of mice (C57/BL). The Journal of nutrition, 1999. 129(10): p. 1891-1895.
- Watanabe-Kamiyama, M., et al., Absorption and effectiveness of orally administered low molecular weight collagen hydrolysate in rats. Journal of agricultural and food chemistry, 2010. 58(2): p. 835-841.
- Alcock, R., et al., Plasma amino acid concentrations after the ingestion of dairy and collagen proteins, in healthy active males. Frontiers in nutrition, 2019. 6: p. 163.
- de Paz-Lugo, P., J.A. Lupiáñez, and E. Meléndez-Hevia, High glycine concentration increases collagen synthesis by articular chondrocytes in vitro: acute glycine deficiency could be an important cause of osteoarthritis. Amino Acids, 2018. 50(10): p. 1357- 1365.
- Murakami, H., et al., Importance of amino acid composition to improve skin collagen protein synthesis rates in UV-irradiated mice. Amino Acids, 2012. 42(6): p. 2481-2489.
- Aoki, M., et al., Increasing effect of an oral intake of L-hydroxyproline on the soluble collagen content of skin and collagen fragments in rat serum. Bioscience, biotechnology, and biochemistry, 2012. 76(6): p. 1242-1244.
- Schwarz, R., R. Mandell, and M. Bissell, Ascorbate induction of collagen synthesis as a means for elucidating a mechanism of quantitative control of tissue-specific function. Molecular and cellular biology, 1981. 1(9): p. 843-853.
- Pinnell, S.R., S. Murad, and D. Darr, Induction of collagen synthesis by ascorbic acid: a possible mechanism. Archives of dermatology, 1987. 123(12): p. 1684-1686.
- Lee, J., et al., Panax ginseng induces human Type I collagen synthesis through activation of Smad signaling. Journal of ethnopharmacology, 2007. 109(1): p. 29-34.
- Lee, J., et al., Asiaticoside induces human collagen I synthesis through TGFβ receptor I kinase (TβRI kinase)-independent Smad signaling. Planta medica, 2006. 72(04): p. 324- 328.
- Kim, S.-H., Method for stimulation collagen synthesis and/or KGF expression. 2010, Google Patents.
- Schneider, L.M., D.J. Pusateri, and T.Q. La, Compositions and methods for stimulating synthesis of pro-collagen or collagen and hyaluronic acid. 2010, Google Patents.
- Murakami, H. and H. Kobayashi, Amino acid composition promoting collagen synthesis. 2010, Google Patents.
- Chotphruethipong, L., R.E. Aluko, and S. Benjakul, Hydrolyzed collagen from porcine lipase-defatted seabass skin: Antioxidant, fibroblast cell proliferation, and collagen production activities. Journal of Food Biochemistry, 2019. 43(5): p. e12825.
- Bellon, G., et al., Glutamine increases collagen gene transcription in cultured human fibroblasts. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 1995. 1268(3): p. 311-323.
- Hamanaka, R.B., et al., Glutamine metabolism is required for collagen protein synthesis in lung fibroblasts. American journal of respiratory cell and molecular biology, 2019. 61(5): p. 597-606.
- Portu, J., et al., Amino acid content in red wines obtained from grapevine nitrogen foliar treatments: consumption during the alcoholic fermentation. Wine Studies, 2014. 3(1).
- Benjakul, S., S. Karnjanapratum, and W. Visessanguan, Hydrolysed collagen from Lates calcarifer skin: Its acute toxicity and impact on cell proliferation and collagen production of fibroblasts. International Journal of Food Science & Technology, 2018. 53(8): p. 1871-1879.
- Vázquez, J.J. and E.S.M. Martínez, Collagen and elastin scaffold by electrospinning for skin tissue engineering applications. Journal of Materials Research, 2019. 34(16): p. 2819-2827.
- Lin, P.-S., et al., Transforming growth factor beta 1 increases collagen content, and stimulates procollagen I and tissue inhibitor of metalloproteinase-1 production of dental pulp cells: Role of MEK/ERK and activin receptor-like kinase-5/Smad signaling. Journal of the Formosan Medical Association, 2017. 116(5): p. 351-358.
- Zague, V., et al., Collagen hydrolysate intake increases skin collagen expression and suppresses matrix metalloproteinase 2 activity. Journal of medicinal food, 2011. 14(6): p. 618-624.
- Proksch, E., et al., Oral intake of specific bioactive collagen peptides reduces skin wrinkles and increases dermal matrix synthesis. Skin pharmacology and physiology, 2014. 27(3): p. 113-119.
- Garg, C., Molecular mechanisms of skin photoaging and plant inhibitors. International Journal of Green Pharmacy (IJGP), 2017. 11(02).
- Gref, R., et al., Vitamin c–squalene bioconjugate promotes epidermal thickening and collagen production in human skin. Scientific Reports, 2020. 10(1): p. 1-12.
- Pinnell, S.R., S. Murad, and D. Darr, Induction of collagen synthesis by ascorbic acid: a possible mechanism. Archives of dermatology, 1987. 123(12): p. 1684-1686.
- Bolke, L., et al., A collagen supplement improves skin hydration, elasticity, roughness, and density: Results of a randomized, placebo-controlled, blind study. Nutrients, 2019. 11(10): p. 2494.
- Choi, S.Y., et al., Effects of collagen tripeptide supplement on skin properties: A prospective, randomized, controlled study. Journal of Cosmetic and Laser Therapy, 2014. 16(3): p. 132-137.
- Park, K.-Y. and J. Kim, Synthesis and Biological Evaluation of Ascorbyl-Conjugated Peptide Derivatives as Collagen Synthesis Stimulating Agents in Human Skin Fibroblasts. International Journal of Peptide Research and Therapeutics, 2020: p. 1-8.
- Chen, X., et al., Panax ginseng total protein promotes proliferation and secretion of collagen in NIH/3T3 cells by activating extracellular signal-related kinase pathway. Journal of Ginseng Research, 2017. 41(3): p. 411-418.
- Lee, R., et al., Ginseng gintonin enhances hyaluronic acid and collagen release from human dermal fibroblasts through lysophosphatidic acid receptor interaction. Molecules, 2019. 24(24): p. 4438.
- Lee, G.Y., et al., Effects of Panax ginseng extract on human dermal fibroblast proliferation and collagen synthesis. International wound journal, 2016. 13: p. 42-46.
- Lu, L., et al., Asiaticoside induction for cell‐cycle progression, proliferation and collagen synthesis in human dermal fibroblasts. International Journal of Dermatology, 2004. 43(11): p. 801-807.
- Nowwarote, N., et al., Asiaticoside induces type I collagen synthesis and osteogenic differentiation in human periodontal ligament cells. Phytotherapy Research, 2013. 27(3): p. 457-462.
- Paocharoen, V., The efficacy and side effects of oral Centella asiatica extract for wound healing promotion in diabetic wound patients. J Med Assoc Thai, 2010. 93(Suppl 7): p. S166-S170.
- 1. Garg, C., Molecular mechanisms of skin photoaging and plant inhibitors. International Journal of Green Pharmacy (IJGP), 2017. 11(02).
- 2. Gref, R., et al., Vitamin c–squalene bioconjugate promotes epidermal thickening and collagen production in human skin. Scientific Reports, 2020. 10(1): p. 1-12.
- 3. Pinnell, S.R., S. Murad, and D. Darr, Induction of collagen synthesis by ascorbic acid: a possible mechanism. Archives of dermatology, 1987. 123(12): p. 1684-1686.
- 4. Bolke, L., et al., A collagen supplement improves skin hydration, elasticity, roughness, and density: Results of a randomized, placebo-controlled, blind study. Nutrients, 2019. 11(10): p. 2494.
- 5. Choi, S.Y., et al., Effects of collagen tripeptide supplement on skin properties: A prospective, randomized, controlled study. Journal of Cosmetic and Laser Therapy, 2014. 16(3): p. 132-137.
- 6. Park, K.-Y. and J. Kim, Synthesis and Biological Evaluation of Ascorbyl-Conjugated Peptide Derivatives as Collagen Synthesis Stimulating Agents in Human Skin Fibroblasts. International Journal of Peptide Research and Therapeutics, 2020: p. 1-8.
- 7. Chen, X., et al., Panax ginseng total protein promotes proliferation and secretion of collagen in NIH/3T3 cells by activating extracellular signal-related kinase pathway. Journal of Ginseng Research, 2017. 41(3): p. 411-418.
- 8. Lee, R., et al., Ginseng gintonin enhances hyaluronic acid and collagen release from human dermal fibroblasts through lysophosphatidic acid receptor interaction. Molecules, 2019. 24(24): p. 4438.
- 9. Lee, G.Y., et al., Effects of Panax ginseng extract on human dermal fibroblast proliferation and collagen synthesis. International wound journal, 2016. 13: p. 42-46.
- 10. Lu, L., et al., Asiaticoside induction for cell‐cycle progression, proliferation and collagen synthesis in human dermal fibroblasts. International Journal of Dermatology, 2004. 43(11): p. 801-807.
- Nowwarote, N., et al., Asiaticoside induces type I collagen synthesis and osteogenic differentiation in human periodontal ligament cells. Phytotherapy Research, 2013. 27(3): p. 457-462.
- Paocharoen, V., The efficacy and side effects of oral Centella asiatica extract for wound healing promotion in diabetic wound patients. J Med Assoc Thai, 2010. 93(Suppl 7): p. S166-S170.
- Benjakul, S., S. Karnjanapratum, and W. Visessanguan, Hydrolysed collagen from Lates calcarifer skin: Its acute toxicity and impact on cell proliferation and collagen production of fibroblasts. International Journal of Food Science & Technology, 2018. 53(8): p. 1871-1879.
56 . Lee, J., et al., Asiaticoside induces human collagen I synthesis through TGFβ receptor I kinase (TβRI kinase)-independent Smad signaling. Planta medica, 2006. 72(04): p. 324-328.
- Chen, X., et al., Panax ginseng total protein promotes proliferation and secretion of collagen in NIH/3T3 cells by activating extracellular signal-related kinase pathway. Journal of Ginseng Research, 2017. 41(3): p. 411-418.
- Watanabe-Kamiyama, M., et al., Absorption and effectiveness of orally administered low molecular weight collagen hydrolysate in rats. Journal of agricultural and food chemistry, 2010. 58(2): p. 835-841.
- Osawa, Y., et al., Absorption and metabolism of orally administered collagen hydrolysates evaluated by the vascularly perfused rat intestine and liver in situ. Biomedical Research, 2018. 39(1): p. 1-11.
- Lee, H.-J., et al., Orally administered collagen peptide protects against UVB-induced skin aging through the absorption of dipeptide forms, Gly-Pro and Pro-Hyp. Bioscience, biotechnology, and biochemistry, 2019. 83(6): p. 1146-1156.
- Li, P. and G. Wu, Roles of dietary glycine, proline, and hydroxyproline in collagen synthesis and animal growth. Amino acids, 2018. 50(1): p. 29-38.
- Wang, W., et al., Glycine metabolism in animals and humans: implications for nutrition and health. Amino acids, 2013. 45(3): p. 463-477.
- Karna, E., et al., Proline-dependent regulation of collagen metabolism. Cellular and Molecular Life Sciences, 2020. 77(10): p. 1911-1918.
64.. Wu, Z., et al., Metabolism, nutrition, and redox signaling of hydroxyproline. Antioxidants & redox signaling, 2019. 30(4): p. 674-682.
- Callejas, A.C.M.M., Understanding bioidentical hormones and their effect on quality of life. Journal of Prescribing Practice, 2020. 2(1): p. 18-22.
- Razzak, M. and J.K. De Brabander, Lessons and revelations from biomimetic syntheses. Nature chemical biology, 2011. 7(12): p. 865-875.
- Sharma, S., R. Gupta, and S.C. Thakur, Attenuation of collagen induced arthritis by Centella asiatica methanol fraction via modulation of cytokines and oxidative stress. Biomedical and Environmental Sciences, 2014. 27(12): p. 926-938.
- Sabaragamuwa, R., C.O. Perera, and B. Fedrizzi, Centella asiatica (Gotu kola) as a neuroprotectant and its potential role in healthy ageing. Trends in Food Science & Technology, 2018. 79: p. 88-97.
- Tsoukalas, D., et al., Discovery of potent telomerase activators: Unfolding new therapeutic and anti-aging perspectives. Molecular medicine reports, 2019. 20(4): p. 3701-3708.
- Riaz, M., et al., Ginseng: A dietary supplement as immune-modulator in various diseases. Trends in food science & technology, 2019. 83: p. 12-30. 71. Shin, H.-J., et al., Preventive effects of Korean red ginseng on experimentally induced colitis and colon carcinogenesis. Journal of Traditional and Complementary Medicine, 2020. 10(3): p. 198-206.
- Ma, G.-D., et al., Changbai Mountain ginseng (Panax ginseng CA Mey) extract supplementation improves exercise performance and energy utilization and decreases fatigue-associated parameters in mice. Molecules, 2017. 22(2): p. 237.
- Benito-Ruiz, P., et al., A randomized controlled trial on the efficacy and safety of a food ingredient, collagen hydrolysate, for improving joint comfort. International journal of food sciences and nutrition, 2009. 60(sup2): p. 99-113.
- Bosman, F.T. and I. Stamenkovic, Functional structure and composition of the extracellular matrix. The Journal of Pathology: A Journal of the Pathological Society of Great Britain and Ireland, 2003. 200(4): p. 423-428.
- Jeong, S.Y., et al., Identification of the Phytochemical Compounds and Their Type I Procollagen Induction in Astragalus membranaceus Sprouts Grown under Different Light Conditions. Journal of Applied Pharmaceutical Science, 2018. 8(06): p. 001-007.
- Sadiq, A., et al., Effects of essential amino acid “Tryptophan” in post burn skin wound healing. International Journal of Biosciences, 2018: p. 147-153.
- Friedman, M., Analysis, nutrition, and health benefits of tryptophan. International Journal of Tryptophan Research, 2018. 11: p. 1178646918802282.
78.. Skov, K., et al., Enzymatic hydrolysis of a collagen hydrolysate enhances postprandial absorption rate—A randomized controlled trial. Nutrients, 2019. 11(5): p. 1064.
- Gropper, S.S. and P.B. Acosta, Effect of simultaneous ingestion of l‐amino acids and whole protein on plasma amino acid and urea nitrogen concentrations in humans. Journal of Parenteral and Enteral Nutrition, 1991. 15(1): p. 48-53.
- Nakayama, K., C. Sanbongi, and S. Ikegami, Effects of whey protein hydrolysate ingestion on postprandial aminoacidemia compared with a free amino acid mixture in young men. Nutrients, 2018. 10(4): p. 507.
- Han, B. and M.E. Nimni, Transdermal delivery of amino acids and antioxidants enhance collagen synthesis: in vivo and in vitro studies. Connective tissue research, 2005. 46(4-5): p. 251-257.
- Kwon, Y.W., et al., N-acetylated proline-glycine-proline accelerates cutaneous wound healing and neovascularization by human endothelial progenitor cells. Scientific reports, 2017. 7(1): p. 1-13.
- Corsetti, G., et al., Topical application of dressing with amino acids improves cutaneous wound healing in aged rats. Acta histochemica, 2010. 112(5): p. 497-507.
- Al-Niaimi, F. and N.Y.Z. Chiang, Topical vitamin C and the skin: mechanisms of action and clinical applications. The Journal of clinical and aesthetic dermatology, 2017. 10(7): p. 14.
- Pullar, J.M., A.C. Carr, and M. Vissers, The roles of vitamin C in skin health. Nutrients, 2017. 9(8): p. 866.
86.. Escobar, S., et al., Effectiveness of a formulation containing peptides and vitamin C in treating signs of facial ageing: three clinical studies. International Journal of Cosmetic Science, 2021. 43(2): p. 131-135.
- Venesia, N.F., E. Fachrial, and I.N.E. Lister, Effectiveness Test of Centella Asiatica Extract on Improvement of Collagen and Hydration in Female White Rat (Rattus Norwegicus Wistar). American Scientific Research Journal for Engineering, Technology, and Sciences (ASRJETS), 2020. 65(1): p. 98-88. Hwang, E., et al., Efficacy and safety of enzyme-modified Panax ginseng for anti-wrinkle therapy in healthy skin: a single-center, randomized, double-blind, placebo-controlled study. Rejuvenation research, 2015. 18(5): p. 449-457.
- Ammala, A., Biodegradable polymers as encapsulation materials for cosmetics and personal care markets. International journal of cosmetic science, 2013. 35(2): p. 113-124.
Häufig gestellte Fragen
Über Kollagen:
Kollagen ist das am häufigsten vorkommende Strukturprotein im Körper. Es besteht aus Bausteinen, sogenannten Aminosäuren, in einer bestimmten Reihenfolge und Form. Sie können sich Kollagen als den Klebstoff vorstellen, der alles zusammenhält und Gewebe wie Haut, Knochen, Knorpel usw. Festigkeit verleiht.
Unsere Haut besteht insbesondere zu bis zu 70% aus Kollagen eines bestimmten Typus – Kollagen Typ-1. Es ist dieses Kollagen, das der Haut Festigkeit und Fülle verleiht.
Nichts Dramatisches, aber Ihr Körper kehrt zu seinem alten Regenerationsniveau zurück und zeigt nach und nach wieder Anzeichen
der Hautalterung.
Tierisches Kollagen ist für den Menschen sehr schwer verdaulich, daher handelt es sich bei Nahrungsergänzungsmitteln mit tierischem Kollagen in der Regel um Kollagenpeptide. Vereinfacht ausgedrückt bedeutet dies, dass das große Kollagenmolekül zur leichteren Absorption in kleinere Stücke geschnitten wurde. Diese Peptide sind Kombinationen von Bausteinen, die Aminosäuren genannt werden. Der Körper verdaut die Peptide und zerlegt sie in Aminosäuren, die für den Aufbau von Kollagen erforderlich sind.
ÜBER HIGH COLLAGEN Vegan Boost®:
VeCollal® ist ein veganes Biomimetikum des menschlichen Kollagens Typ-1. Das klingt kompliziert, bedeutet aber, dass es genau das gleiche Aminosäureprofil wie menschliches Kollagen Typ 1 aufweist – dieses macht den größten Teil des Kollagens in Ihrer Haut und Ihren Knochen aus.
Kollagen besteht aus bestimmten Bausteinen (Aminosäuren) in einem bestimmten Verhältnis.
VeCollal® hat das exakte Verhältnis zum Kollagen in der menschlichen Haut. Dies ist einzigartig, da tierisches Kollagen dem menschlichen Kollagen ähnelt, jedoch nicht identisch ist. Es fehlen ihm sogar einige für den Menschen lebenswichtige Bausteine (z. B. eine Aminosäure namens L-Tryptophan). VeCollal® versorgt den menschlichen Körper optimal mit Bausteinen für die Bildung von neuem Kollagen. Allerdings reicht es nicht aus, nur über die Bausteine zu verfügen, um effektiv zu bauen. Wenn wir zum Beispiel ein Haus bauen wollen, genügt es nicht, das Haus mit den Ziegeln allein zu bauen, dafür braucht man eine Anleitung. Aus diesem Grund enthält der zum Patent angemeldete VeCollal®-Inhaltsstoff auch leistungsstarke Kräuterextrakte, die den Körper dazu anregen, die Bausteine zu verwenden, um mit dem Bauen zu beginnen. VeCollal® nutzt im Wesentlichen die körpereigene Biochemie, um Kollagen wieder
aufzufüllen.
Kollagenpräparate erfreuen sich großer Beliebtheit, aber der moderne Verbraucher legt zum Glück immer mehr Wert auf Nachhaltigkeit und Tierwohl. Dies zeigt sich deutlich in der wachsenden Zahl pflanzlicher Produkte auf dem Markt und den weltweiten Nachhaltigkeitsbemühungen.
VeCollal® wurde entwickelt, um den Anforderungen des modernen Verbrauchers gerecht zu werden, der Wert auf Nachhaltigkeit legt, Veganer oder Vegetarier ist, aber dennoch keine Kompromisse bei den Ergebnissen eingehen möchte.
Nein, es ist eine vegane Kollagen-Alternative. Das heißt, es bietet dem Körper alle Vorteile von tierischem Kollagen auf nachhaltige, tierfreundliche
Weise.
Die Ergebnisse unserer neuesten klinischen Studie stimmen mit den Ergebnissen ähnlicher Studien überein, die mit tierischen Kollagenpräparaten durchgeführt wurden. HIGH COLLAGEN Vegan Boost® mit VeCollal® scheint ähnliche Ergebnisse zu erzielen, jedoch in einem kürzeren Zeitraum (4 Wochen), was unserer Meinung nach auf die sehr hohe Absorptionsfähigkeit von VeCollal® zurückzuführen ist, dessen Molekülgröße 10 bis 50 Mal kleiner als die von Kollagenpeptiden ist.
VeCollal® liefert überzeugende Ergebnisse in nur 4 Wochen:
- 14,1 % Reduzierung der Falten
- 13,9 % Steigerung der Kollagendichte
- 7,4 % Steigerung der Hautfeuchftigkeit
- 16,3 % Reduzierung der Hautrötung
- 15,8 % Reduzierung der Hautrauigkeit
Während der klinischen Studie wurden Blutwerte und Magen-Darm-Beschwerden überwacht – Nebenwirkungen jeglicher Art wurden nicht gemeldet.